Misión 5: Las proteínas
- luciamompean
- 1 nov 2018
- 10 Min. de lectura
Actualizado: 10 nov 2018
¡Hola amigos científicos!
En esta entrada os presento el tema de las proteínas visto en clase recientemente.
Comenzaré explicando los diferentes puntos del esquema general de las proteínas donde añadiré imágenes que os ayudarán a comprender mejor el temario.
Terminaré con mis respuestas de las preguntas de repaso de PAU y de las preguntas de las proteínas situadas en la Misión 5.
¡Espero que os guste!
ESQUEMA PROTEÍNAS
Fuente propia
En primer lugar, como podéis observar en el esquema, comienzo por los aminoácidos para luego llegar a péptidos y finalmente a las proteínas.
Los aminoácidos son compuestos orgánicos sencillos, de bajo peso molecular, sólidos, incoloros, solubles en agua, con elevado punto de fusión, cristalizables.
Están formados por un grupo amino, carboxílico, un átomo de hidrógeno y una cadena lateral que se unen al carbono alfa mediante enlaces covalentes.
Todos los aminoácidos excepto la Glicocola presentan carbono asimétrico, lo que hace que presenten esteroisomería. Cada aminoácido presenta dos esteroisómeros dependiendo de la posición del grupo amino. Si el grupo amino está a la derecha tendrá configuracion D, si está a la izquierda tendrá configuración L.
La presencia de carbono asimétrico, además les da actividad óptica, son capaces de desviar el plano de polarización de la luz a la derecha (dextrógiro) o a la izquierda (levógiro). Al igual que en los glúcidos, que una proteína sea dextrógira o levógira, NO está relacionado con su forma D o L.
Los aminoácidos son sustancias anfóteras porque en disolución acuosa son capaces de comportarse como ácidos o bases dependiendo del pH de la disolución, esto es debido a que el grupo carboxílico que tiene carácter ácido y el amino tiene carácter básico.
Si disminuye el pH, el medio se hace ácido, aumenta la concentración de protones y el aminoácido tiende a neutralizar esa acidez, captando protones. El proceso sería al contrario si aumentara el pH.
-Según su polaridad los podemos dividir en hidrófobos, hidrofílicos, ácidos y básicos.
-Dependiendo del número de aminoácidos que presentan, los péptidos pueden ser:
dipéptidos, tripéptidos, oligopéptidos y polipéptidos. Estos aminoácidos forman cadenas uniéndose entre sí mediante enlaces peptídicos que se establecen entre el grupo carboxílico de un aminoácido y el grupo amino del siguiente, como consecuencia, se pierde una molécula de agua.
Este enlace peptídico tiene un cierto carácter de doble enlace, lo que le impide girar libremente, haciendo que los cuatro átomos que forman parte del enlace péptidico y los dos átomos de carbono que se unen a él se encuentren en un mismo plano.
Las proteínas son polipéptidos y unas de las biomoléculas orgánicas más importantes debido a su abundancia y a la gran variedad de funciones que llevan a cabo.
Químicamente son polímeros de aminoácidos unidos mediante enlaces peptídicos y dispuestos de forma lineal.
Las proteínas se disponen en el espacio formando una estructura tridimensional que puede tener hasta cuatro niveles de organización:
Estructura primaria:
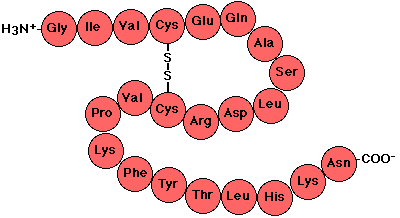
Es una secuencia lineal de aminoácidos que compone la proteína.
Tiene disposición en zigzag debido a la planaridad de los enlaces peptídicos y esto produce una rotación de los aminoácidos sobre el carbono alfa.
Entre los aminoácidos hay enlaces covalentes.
Estructura secundaria:
Es la disposición espacial que adopta la estructura primaria para que pueda ser estable, tiene capacidad de giro gracias a los enlaces no peptídicos.
En esta estructura encontramos enlaces covalentes, y enlaces de puentes de hidrógeno (en la hélice de colágeno son débiles).
La representación de la estructura secundaria de una proteína quedaría de la siguiente forma:
Podemos distinguir tres tipos de estructura secundaria:
Alfa hélice:
La cadena proteica que posee estructura primaria, se enrolla en espiral sobre sí misma debido a los giros que se producen en alrededor del carbono alfa de cada aminoácido.
La rotación es hacia la derecha (dextrógiro), y cada vuelta contiene 3,6 aminoácidos. La cadena se mantiene estable gracias a los enlaces de hidrógeno intracatenario que se establecen entre el grupo amino de un enlace peptídico y el grupo -C=O del cuarto aminoácido que le sigue.
Fuente: Wikipedia.
Conformación beta:
Las cadenas conservan su estructura primaria en zigzag y se asocian entre sí estableciendo uniones mediante enlaces de hidrógeno intercatenarios.
Las cadenas se pueden unir de forma paralela, y las cadenas peptídicas quedarán hacia el mimo sentido, o se pueden unir de forma antiparalela en la que las cadenas pesticidas se orientan en dos direcciones.
En esta foto podemos observar una lámina b antiparalela y paralela:
En las láminas b los giros se forman por la unión de un puente de hidrógeno del aminoácido n y el n+3:
Hélice de colágeno:
Es una estructura rígida compuesta por prolina y por hidroxiprolina. Se enrolla de foma levógira y es más alargada que la alfa hélice. En cada vuelta hay 3 aminoácidos.
Es característica del colágeno que está formado por tres hélices que forman una superhélice. Estas hélices se unen por medio de enlaces covalentes y por enlaces débiles.
Estructura terciaria:
Es la disposición que adopta en el espacio la estructura secundaria cuando se pliega sobre sí misma y forma una conformación globular.
Se mantiene estable gracias a las interacciones que se establecen entre las cadenas laterales de los aminoácidos. Estas interacciones pueden ser: puentes disulfuro, puentes hidrógeno, interacciones electróstáticas, fuerzas Van Der Walls e hidrófobas.
Existen dos tipos de proteínas según su estructura:
- Globulares: presentan una estructura compleja, son solubles en agua y en disoluciones salinas. Realizan funciones activas.
-Filamentosas: presentan una estructura más sencilla, son insolubles y realizan la función estructural.
Esta foto representa una proteína globular (mioglobina):
Estructura cuaternaria:
Esta estructura la presentan las proteínas que están formadas por dos o más cadenas polipeptídicas, unidas por enlaces débiles y en ocasiones por enlaces disulfuro.
Cada cadena se denomina protómero, según el número de estos, la proteína puede ser; dímero, trímero...
En esta foto, observamos la hemoglobina que es un tetrámero, formada por dos cadenas alfa y dos beta:
En esta foto tenemos un resumen de los distintos niveles de estructura de una proteína:
PD: Todas las imágenes de la estructura de la proteína excepto la de la alfa hélice están sacadas de los segundos apuntes que hay en el colegio virtual.
Una vez visto la estructura de la proteína, podemos hablar de su clasificación en:
-Holoproteínas: son las que están formadas por aminoácidos como las proteínas globulares (actina, albúmina) y filamentosas (colágeno, miosina).
-Heteroproteínas: son las que está formadas por aminoácidos (parte proteica) y un grupo prostético (parte no proteína) como las cromoproteínas (hemoglobina, hemocianina), nucleoproteínas (Histonas), glucoproteínas (inmunoglobinas), lipoproteínas (LDL) y fosfoproteínas (vitelina).
El siguiente punto a comentar del esquema son las propiedades de las proteínas:
Solubilidad: los radicales polares se encuentran en la superficie externa de la proteína estableciendo enlaces de hidrógeno con el agua. Por esta propiedad, podemos decir que las proteínas globulares son solubles y las fibrosas son insolubles.
Desnaturalización: Se produce la rotura de los enlaces que mantienen el estado nativo de la proteinas, como consecuencia se pierde la estructura terciaria, secundaria y cuaternaria, la función biológica y precipita.
Esta desnaturalización es producida por diversos factores, y puede ser reversible siempre y cuando no haya afectado a los enlaces pesticidas.
Especificidad: puede ser de función o de especie.
-Función: depende de la posición que adopten los aminoácidos que forman la secuencia lineal de la proteínas.
-Especie: existen proteínas exclusivas para las especies. Las proteínas homólogas son aquellas que tienen la misma función en distintas especies y presenta una similar composición y estructura porque tienen aminoácidos similares.
Capacidad amortiguadora: amortiguan las variaciones de pH del medio gracias a su comportamiento anfótero.
Una vez visto las propiedades las proteínas podemos finalizar hablando de sus funciones que están relacionadas con todo los anterior:
-Reserva: almacenan aminoácidos para utilizarlos como nutrientes.
-Estructural: funcionan como soporte mecánico de las células.
-Enzimática: las enzimas son catalizadores que aumentan la velocidad de las reacciones químicas.
-Hormonal: intervinen en el metabolismo.
-Protectora: realizan una funciín defensiva para el organismo.
-Contractil: como la actina y miosina que interviene en la contracción muscular.
-Homeostática: relacionada con su capacidad amortiguadora
-Transporte: se unen a diversas sustancias y las transportan.
-Reconocen señales químicas: las señales de las hormonas, bacterias son reconocidas por células que están en la superficie de membranas celulares.
Espero que os haya sido de guía para seguir el esquema.
Cualquier duda, ¡pregúntela!
Os dejo con las cuestiones:
ACTIVIDADES DE PAU
1.En la siguiente reacción dos monómeros reaccionan para formar un dímero:
a) ¿Qué moléculas son estos monómeros? ¿En qué tipo de macromoléculas se encuentra está unión?
Estos monómeros son aminoácidos. Se encuentran en proteínas o péptidos.
b) ¿Cómo se denomina el enlace que se forma entre estos monómeros ?¿Cuáles son las características de este enlace?
El enlace que une a los aminoácidos se llama enlace peptídico.
El enlace peptídico es un enlace covalente más corto que la mayor parte de los enlaces C-N. Posee un carácter de doble enlace lo que le impide girar libremente, haciendo que los cuatro átomos que forman parte del enlace peptídico y los dos átomos de carbono que se unen a él, se encuentren en un mismo plano.
c) Cita dos ejemplos de esta macromolécula e indica su función.
La tubulina que forma parte del citoesqueleto y participa en la formación del huso mitótico.
Las inmunoglobinas que defienden al organismo contra los patógenos.
La hemoglobina que transporta el oxígeno desde el aparato respiratorio hasta las células.
2. Explica el tipo de interacciones o enlaces que estabilizan la estructura secundaria y terciaria en proteínas.
El mantetenimiento de la estructura secundaria de tipo alfa hélice se debe principalmente a los enlaces de hidrógeno intracatenarios formados entre el grupo -NH y -C=O del enlace peptídico. La estructura secundaria lámina plegada mantiene su estructura primaria en zigzag asociándose entre sí estableciendo uniones mediante enlaces de hidrógeno intercatenarios. Estos enlaces aportan una gran estabilidad a la molécula. La estructura terciaria se mantiene estable por las interacciones entre las cadenas laterales de los aminoácidos. Estas interacciones pueden ser: puentes de hidrógeno entre grupos peptídicos, puentes de disulfuro entre dos residuos de cisteína,
fuerzas de Van Der Waals e interacciones hidrofóbicas entre los grupos apolares, interacciones electrostáticas entre grupos con carga opuesta. Estos enlaces son todos débiles excepto los puentes disufuro que es un enlace fuerte.
3. ¿Qué significa que los aminoácidos son anfóteros?¿A qué se debe esa característica?
Los aminoácidos son sustancias anfóteras porque en disolución acuosa pueden comportarse como un ácido o una base dependiendo del Ph de la disolución, esto es debido a la presencia del grupo carboxílico que tiene carácter ácido y del grupo amino que tiene carácter básico.
4. En relación a la estructura de proteínas:
a) Explica qué es la estructura terciaria y qué tipo de fuerzas o interacciones participan en el mantenimiento de la estructura terciaria. ¿Existe un nivel superior a la estructura terciaria? En caso afirmativo, indica en qué ocasiones se forma.
La estructura terciaria es la disposión que adopta en el espacio la estructura secundaria cuando se pliega sobre sí misma y origina una conformación globular.
Esta estructura se mantiene estable gracias a las interacciones que se forman entre las cadenas laterales de los aminoácidos. Estas interacciones pueden ser: puentes de hidrógeno, puentes disulfuro, interacciones electrostáticas, fuerzas de Van Der Waals e interacciones hidrfóbicas.
Sí que existe un nivel superior a la estructura terciaria, y es la estructura cuaternaria que ocurre únicamente cuando las proteínas están formadas por dos o más cadenas polipeptídicas.
b) Al medir la actividad de la enzima hexoquinasa se produjo, accidentalmente, un aumento de la temperatura hasta los 80ºC. En estas condiciones no se detectó actividad de la enzima. Explica qué proceso justifica esta observación.
El proceso que justifica la observación es la desnaturalización de la proteína porque al elevar la temperatura, aumenta la energía cinética de la molécula, se desorganiza la envoltura acuosa de la proteína, se destruyen las interacciones débiles, y se desorganiza su estructura.
Por lo tanto, la proteína pierde su conformación nativa y su función biológica, en este caso la función enzimática.
ACTIVIDADES PROTEÍNAS
1. Con respecto a las proteínas:
a) Enumerar los cuatro niveles de estructura de las proteínas.
-Estructura primaria.
-Estructura secundaria: alfa hélice, lámina plegada y hélice de colágeno.
-Estructura terciaria.
-estructura cuaternaria.
b) Indicar qué tipos de enlaces intervienen en la estabilización de cada uno de estos niveles estructurales.
En la estructura primaria se encuentran enlaces peptídicos y entre los aminoácidos hay enlaces covalentes.
En la estructura secundaria se encuentran enlaces de puentes de hidrógeno (son intracaterios en la alfa hélice, intercatenarios en la lámina plegada y en la hélice de colágeno son débiles), y enlaces covalentes.
En la estructura terciaria se encuentran enlaces de puentes disulfuro, enlaces de hidrógeno, fuerzas Van Der Waals, enlaces hidrófobos y fuerzas electrostáticas.
En la estructura cuaternaria se encuentran enlaces débiles que no son covalentes y en ocasiones enlaces disulfuro.
c) Especificar la estructura que caracteriza a las α-queratinas.
Las α-queratinas están formadas por estructura secundaria y más concretamente pertenece a la alfa hélice.
Esta estructura secundaria está formada por una cadena proteica con estructura primaria que se enrolla en espiral sobre sí misma debido a los giros que se producen en torno al carbono alfa, el giro es dextrógiro. Se sustenta gracias a los enlaces de hidrógeno intracatenarios que se establecen entre el -NH del enlace peptídico y el -C=O del cuarto aminoácido que le sigue..
d) Describir dos propiedades generales de las proteínas.
Capacidad amortiguadora: las proteínas debido a su carácter anfótero pueden comportarse como ácidos o bases, dependiendo del pH de la disolución, esto es debido a la presencia de aminoácidos con grupos ionizables, que pueden captar y ceder protones. De esta manera amortiguan las variaciones de pH del medio en el que se encuentran.
Solubilidad: la solubilidad depende de factores como: pH, conformación, disposición de radicales polares. Las proteínas que tienen conformación filamentosa son insolubles mientras, que las que tienen conformación globular son solubles en agua. La solubilidad se debe a que los radicales polares localizados en la superfie externa de las proteínas establecen enlaces de hidrógeno con el agua. De esta manera la proteína queda rodeada por una capa de agua llamada capa de solvatación, que impide su unión con otras moléculas y su precipitación.
e) Describir dos funciones de las proteínas. Indica ejemplo.
-Función de reserva: las proteínas almacenan aminoácidos para utilizarlos como nutrientes o colaborar en la formación del embrión. Como por ejemplo: ovoalbúmina (clara del huevo), cafeína (leche), teína (maíz).
-Función hormonal: las hormonas actúan regulando el metabolismo o la reproducción. Así tenemos la insulina y el glucagón que regulan la concentración de glucosa en sangre. De esta manera, la insulina secretada por el páncreas, interviene cuando las concentraciones de glucosa en sangre son elevadas, y el glucagón actúa cuando los niveles de glucosa en sangre son bajas.
f) Defina el proceso de desnaturalización. ¿Qué tipo de enlaces no se ven afectados?
La desnaturalización es el proceso mediante el cual se produce la rotura de los enlaces que mantiene el estado nativo de la proteína ocasionando la pérdida de la función de la proteína y de la estructura terciaria, cuaternaria y casi siempre la secundaria.
La desnaturalización es causada por diversos factores como el pH, la temperatura, la polaridad del disolvente, sustancias desnaturalizantes (urea), y también por agitación molecular. Ésta rotura de enlaces débiles y disulfuros no afecta a los enlaces peptídicos. Además cuando ocurre este proceso la proteína adquiere una configuración filamentosa y precipita. La proteína puede volver a sus condiciones normales cuando se produce una renaturalización siempre y cuando no estén afectados los enlaces peptídicos.
g) ¿Qué significa que un aminoácido es anfótero?
Un aminoácido es anfótero, es decir, puede actuar como un ácido o una base dependiendo del Ph de la disolución, esto es debido a que el grupo amino tiene carácter basico y el carboxilo carácter ácido. Cuando están en disolución acuosa a pH próximo a la neutralidad los aminoácidos están ionizados formando iones híbridos o dipolares, ya que el grupo carboxílico pierde un protón y el grupo amino gana un protón. El pH en el cual el aminoácido tiene forma dipolar neutra, es decir, está ionizado pero tiene el mismo número de cargas positivas que negativas, recibe el nombre de punto isoelectrico.
























Comentarios